|
前言
Cytarabine 主要是用於治療白血病及淋巴瘤等血液疾病的合成嘧啶衍生物,其常見的毒性反應為骨髓抑制及胃腸道不適。目前cytarabine 用於急性骨髓性白血病的的治療方式,建議採用強化治療(consolidation therapy)取代維持治療(maintenance therapy)。典型的療程是每隔一天每12 小時靜脈輸注cytarabine3 g/m2,輸注時間為1 至3 小時,總共給與8至12 個劑量。高劑量cytarabine 的投與,伴隨而至的肌肉活動協調困難與發音困難等急性小腦毒性(cerebellar toxicity)並不常見。本文介紹一急性骨髓性白血病患者疑似因cytarabine 治療導致神經毒性之案例。
案例報告
45 歲男性患者,97 年9 月被診斷罹患急性骨髓性白血病(acute myeloid leukemia,AML, M2);原先預定97 年11 月7 日至11 月13 日接受誘導化學治療(I3A7,cytarabine(100 mg/m2/day)連續7 天,頭3 天同時給予idarubicin 12 mg/m2/day),後因敗血症於11月11 日暫停此次治療,但此次的誘導治療後,經骨髓檢查,患者的病情有達到完全緩解(complete remission, CR)。接下來,在98 年4 月8 日至12 日接受第一次高劑量cytarabine(3 g/m2,第1,3,5 天,每12 小時一次)強化治療後,4 月14 日開始出現口齒不清、發音困難(dysarthria)、動作障礙(dysmetria)及肌肉活動協調困難(dystaxia)等症狀,病患家屬表示發現病患有說話不清楚之症狀,且病患下床走路時有不穩之情形;4 月15 日經核磁共振攝影(Magnetic Resonance Imaging,MRI)排除腦部之問題後,疑為cytarabine 引起之小腦毒性;當下並未投與任何藥物來治療其小腦毒性所衍生之相關症狀, 4 月20 日症狀逐漸改善,於4 月30 日出院。患者的肝腎功能正常,另外療程中同時併用藥物為:glimepiride , metformin , posaconazole ,
furosemide , allopurinol , granisetron ,diphenhydramine 及metoclopramide。
患者於98 年5 月27 日至31 日繼續接受第二次高劑量cytarabine 強化治療。基於疾病治療之考量,cytarabine 的投與劑量與給藥頻次,仍維持原治療劑量,並嚴密監測病患臨床狀況。6 月9 日患者再度出現輕微的小腦毒性相關症狀,口齒不清、肌肉活動協調困難,6月12 日相關症狀逐漸自行緩解。98 年7 月1日至5 日患者接受第三次高劑量cytarabine 強化治療,此次療程未出現小腦毒性相關症狀。
患者於98 年4 月8 日至98 年7 月5 日期間,一共進行了三次高劑量cytarabine(3 g/m2)強化治療,每次療程為5000 mg,第1,3,5 天,每12 小時投與一次,總共投與18 個劑量。相關確診與治療時程,請見圖一。
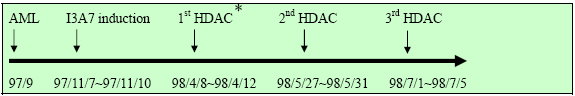
*HDAC:high dose cytarabine
圖一、案例患者診斷與相關治療時程
討論
白血病為人體內的白血球產生病變,失去正常應有的分化及老化能力,並且不斷增生所致之疾病。依其病程進展的緩急,臨床症狀表現的輕重,以及惡性白血球起源之不同,可分為急性骨髓性白血病、慢性骨髓性白血病、急性淋巴性白血病及慢性淋巴性白血病等四種。
急性骨髓性白血病在美國的年發生率約為每十萬人中有3.4 人[1],而且年齡較長者發生的機會較高,而在臺灣的年發生率則為每十萬人中有2.3 人。一旦確認診斷為急性骨髓性白血病,治療的首要目標即是儘快恢復骨髓的正常功能,目前化學治療與血液幹細胞移植(hematopoietic stem cell transplantation)為主要的治療方式。
大約60~80%的急性骨髓性白血病患者經化學治療可達完全緩解[1]。近30~40 年來,合併cytarabine 與anthracycline 的“3+7 療法”(cytarabine(100 mg/m2/day)連續7 天,頭3天合併idarubicin 12 mg/m2/day )是誘導治療的主要選擇。在誘導治療之後,強化治療的藥物選擇有HDAC , MACE (amsacrine,cytarabine, etoposide),及MidAC (mitoxantrone,cytarabine),其中以HDAC 最常被使用。強化治療所需進行的療程數目,目前尚無定論,不過一般建議至少應有3 次療程[1]。
Cytarabine 是cytidine 的衍生物,進入體內後會轉變成ara-C triphosphate (ara-CTP),接著嵌入DNA 並導致細胞的死亡。Anthracycline 類的藥物如daunorubicin,rubidazone, epirubicin 和 idarubicin,其作用機轉為穩定DNA 與拓樸酶(topoisomerase)形成之複合物進而導致細胞死亡。Cytarabine或anthracycline 單獨使用約可達四成的完全緩解,但合併使用後,卻可有近八成的完全緩解[2-3]。另外,在後續的強化治療以高劑量cytarabine(2~3 g/m2)的投與,主要優點為較高的整體存活率(overall survival rates)與較少的復發率(relapse rates),但相關毒性也隨之增加[4-5]。
根據文獻記載,cytarabine 引起之小腦毒性與投與劑量成正向關係,相較於低劑量,投與高劑量(2~3 g/m2)治療或累積劑量增加則約有8~10%的發生率,其中約8~20%為不可逆性[5]。平均發生時間約在首次投藥後的3~8天,停藥後約5~7 天症狀漸緩解,曾發生小腦神經毒性之不良反應之患者,再次接受相同劑量約有60~80%會再發生類似的副作用[6];相關危險因子有:累積劑量>48 g/m2,男性,年齡大於50 歲的患者,肝或腎功能不佳者,曾有中樞神經方面的疾病等[6] 。目前cytarabine 引起小腦毒性的確切作用機轉,尚未完全被了解,有研究顯示可能與小腦中Purkinje cells 的異常有關[7]。另外,文獻建議投與cytarabine 發生小腦毒性時之處理原則為停用藥品及症狀處置;至於steroids 或pyridoxine 對受損神經之修復功效則仍有爭議[8]。文獻建議投與高劑量cytarabine 發生小腦毒性之患者,除停藥、觀察外,藉由調整給藥劑量(依腎功能)、給藥頻次及輸注時間,或可降低cytarabine 其神經毒性的發生率[8]。另外,近年在動物試驗中證實,抗氧化劑(如N-acetylcysteine)的投與,有助於預防神經毒性的發生,而腦脊液(cerebral spinal fluid)的沖洗則為急性期改善症狀之另一選擇[9-10]。雖然本案例皆未使用上述預防措施,但是後續若有因高劑量cytarabine 治療造成小腦毒性副作用之案例時,或許可以考慮上述之預防措施或治療方式。
本案例患者於診斷為急性骨髓性白血病後,投與idarubicin 與cytarabine 為誘導治療藥物,隨後於首次高劑量的cytarabine 投與,即發生藥物不良反應。相較於以往文獻案例報導[5,6,8]或是院內其他案例,本案例發生不良反應的臨床徵候與產生相關症狀的時間點是相類似的(約在投藥後3~8 天內發生);但是本案例其累積投與劑量為30 g (18 g/m2)即發生神經毒性,相較之下顯得略低;除此之外,病患也無肝腎功能不佳及年齡相關的危險因子存在。
基於首次高劑量的cytarabine 投與,即發生藥物不良反應,是否維持相同藥物之治療與療程,成了臨床上考量之處。經和醫師討論後擔憂病人治療效果不佳,因此並未更改往後之療程與使用藥物劑量。所幸第二次療程後cytarabine 引起之小腦毒性之症狀延緩發生,且症狀較輕微;甚至於第三次治療時,並無上述神經毒性不良反應的產生。
結論
本案例之治療情況, 於首次高劑量cytarabine 投與,即發生藥物不良反應,所幸產生之小腦毒性並未對患者的病情造成太大的影響;接著第二次與第三次的治療,藥物不良反應發生的情形,延遲發生且症狀輕微甚至沒有發生。雖然本案例與文獻所收載之案例不盡相同[4,6,8],但對於使用高劑量cytarabine治療的個案,除了要留意可能的危險因子外,治療期間仍應密切監測其藥物不良反應,以期將不良反應發生造成的損傷降到最低,仍是最佳的照護原則。
參考文獻
1. Jacob M Rowe, Martin S Tallman. Therapy for acute myeloid leukemia. In: Hoffman, editors. Hematology: Basic Principles and Practice, 5th ed. 2008. p.965-89.
2. Mayer RJ, Davis RB, Schiffer CA, et al. Intensive post-remission chemotherapy in adults with acute myeloid leukemia. Cancer and Leukemia Group B. N Engl J Med 1994; 331(14): 896-903.
3. Wiernik PH, Banks PL, Case DC Jr, et al. Cytarabine plus idarubicin or daunorubicin as induction and consolidation therapy for previously untreated adult patients with acute myeloid leukemia. Blood 1992; 79(2): 313-9.
4. Slade HJ. Neurological Toxicities Associated with Cancer ChemotherapeuticAgents. U.S. Pharmacist 2005; 30(4):3-18.
5. Baker WJ, Royer Jr GL, Weiss RB. Cytarabine and neurologic toxicity. J Clin Oncol 1991; 9(4):679-93.
6. Herziq RH, Hines JD, Herziq GP, Wolff SN, Cassileth PA, Lazarus HM, et al. Cerebellar toxicity with high-dose cytosine arabinoside. J Clin Oncol 1987; 5(6):927-32.
7. MC Salinsky, RL Levine, JP Aubuchon, HS Schutta. Acute cerebellar dysfunction with High-Dose ARA-C therapy. Cancer 1983; 51:426-9.
8. GA Smith, LE Damon, HS Rugo, CA Ries, CA Linker. High dose cytarabine dose modification reduces the incidence of neurotoxicity in patients with renal insufficiency. J Clin Oncol 1997;15(2): 833-9.
9. Koros C, Kitraki E. Neurofilament isoform alterations in the rat cerebellum following
cytosine arabinoside administration. Toxicol Lett 2009; 189(3): 215-8.
10. Pellier I, Leboucher B, Rachieru P, Ifrah N, Rialland X. Flushing out of cerebrospinal
fluid as a therapy for acute cerebellar dysfunction caused by high dose of cytosine arabinoside: a case report. J Pediatr Hematol Oncol 2006; 28(12): 837-9.
|