|
一、前言
乳癌是女性最常見的癌症,每年全球約有140萬的乳癌新病例且超過45萬人死於乳癌。近年來乳癌的死亡率逐年的下降,因有先進的篩撿技術可以早期發現早期治療,還有不斷研發的輔助治療。乳癌的輔助治療有放射線治療及藥物/全身性治療,藥物輔助治療又分為荷爾蒙治療、化學治療及標靶治療。如何選擇適當的藥物治療可以參考NCCN的guideline(表一)。
當乳癌發生轉移時,大部分是無法治癒的,但可以因治療方法的選擇及標靶藥物的使用而改善病人的存活率。乳癌細胞的表現是選擇治療藥物的重要指標,當癌細胞上有很多HER2受體時,病人的乳癌就會被診斷為HER2-positive。HER2受體的過度表現是會增加乳癌再復發的機率且影響病人的預後。大約有20%的乳癌病人會被診斷為HER2-positive,此時標靶藥物成為治療的首選。Anti-HER2 療法被建議用於轉移性HER2-positive乳癌的第一線治療,因標靶治療可以改善及延長病人的存活率。常見的Anti-HER2 療法有Herceptin(干擾HER2受體的單株抗體)。Herceptin在乳癌的治療上雖有顯著的療效,但對部分病患其療效還是有限的,因為在治療一定時間後,癌細胞是會對Herceptin產生抗藥性的。值得慶幸的是FDA在2012年的6月核准了另一個Anti-HER2 療法的新藥Pertuzumab(Perjeta®)。Pertuzumab被FDA核准用來治療先前未接受Anti-HER2 therapy或化學治療的轉移性HER2-positive乳癌患者,與Herceptin及Docetaxel併用作為第一線藥物治療。
表一:NCCN guidelines for early stage breast cancer adjuvant therapy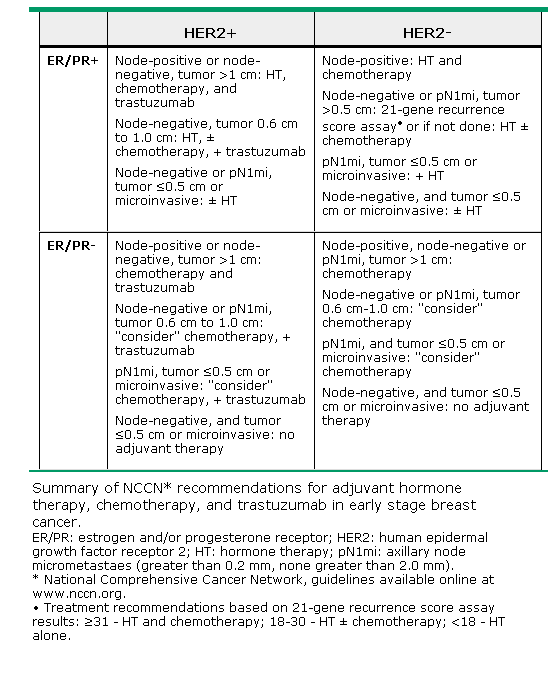
二、Pertuzumab:適應症&作用機轉
癌細胞對Herceptin產生抗藥性的其中一個原因是HER2與其他HER家族中的受體結合形成dimers,加強了細胞內的信息傳導並促進癌細胞成長與形成,Pertuzumab就是針對此抗藥機轉研發出的新藥。
Pertuzumab是一重組的HER2單株抗體,作為一個全新作用機轉分類的藥,是第一個被研發的HER2二聚化抑制劑(HER2 dimerisation inhibitor)。藉由與HER2受體的結合,Pertuzumab阻斷了HER2與其他HER receptor(包括HER1/EGFR, HER3, HER4) 的Dimerization (二聚化)。阻斷HER receptor之間的二聚化可以抑制癌細胞內兩個重要的信息傳導途徑: mitogen-activated protein (MAP) kinase及phosphoinositide 3-kinase(PI3K),進而終止癌細胞的成長,造成細胞凋亡。此外Pertuzumab還會引起antibody-dependent cell-mediated cytotoxicity(ADCC)。Pertuzumab及Herceptin與HER2受體結合的位置並不相同(前者在Subdomain II,後者在subdomain IV),因此Pertuzumab不會影響到Herceptin的作用,兩者間更會形成協同作用,增強抗癌效果(圖一)
圖一:Pertuzumab抑制HER2形成dimers的藥理作用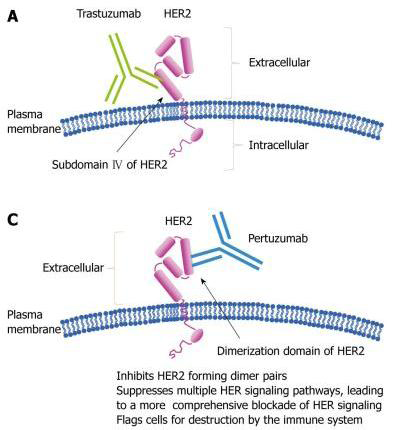
World J Clin Oncol. 2011 February 10; 2(2): 125-134.
三、Pertuzumab:劑量&藥物動力學
Pertuzumab在治療轉移性乳癌的劑量:起始劑量840mg靜脈輸注60分鐘,之後每三週一次420mg的維持劑量輸注30-60分鐘。根據在給予481位病患Pertuzumab之後所做的群體藥物動力學分析所得的結果:Pertuzumab在給予第一次維持劑量後很快就會達到穩定濃度,Pertuzumab的平均清除率是(CL) 0.24 L/day,平均半衰期是18天。在年齡、性別及種族之間藥物動力學並沒有顯著的差異。Baseline serum albumin level 與lean body weight對藥物動力學參數也沒有很大的影響,所以Pertuzumab不需依albumin level 與body weight的改變做藥物劑量的調整。藥物動力分析的結果顯示Pertuzumab在輕度(CLcr 60 to 90 mL/min, n=200)及中度(CLcr 30 to 60 mL/min, n=71)腎功能不全病人的清除率與腎功能正常的患者相似,因此不需調整劑量。在治療期間,如果病患因某些原因須延遲投藥,如延遲的時間大於6週,要繼續投予Pertuzumab時就需從起始劑量840mg再開始。
四、Pertuzumab:副作用&禁忌症
在808名轉移性乳癌病患的臨床試驗CLEOPATRA(Clinical Evaluation of Pertuzumab and Trazumab)中,隨機給予病患Pertuzumab + Trazumab + Docetaxel或Placebo + Trazumab + Docetaxel的治療組合,試驗中觀察到使用Pertuzumab組治療時,最常見的副作用(>30%)是diarrhea (66.8%)、alopecia (60.9%)、neutropenia (52.8%)、nausea (42.3%)、fatigue (37.6%)、rash(33.7%)及peripheral neuropathy (32.4%)。常見的grade 3-4副作用(>2%)有neutropenia (48.9%)、febrile neutopenia (13.8%)、leukopenia (13%)、diarrhea (7.9%)、peripheral neuropathy (3.2%)、anemia (2.5%)、asthenia (2.5%)及fatigue (2.2%)。其中febrile neutopenia的發生率在亞洲人身上有較為顯著。與Placebo組比較後發現diarrhea、rash、mucosal inflammation、febrile neutropenia及dry skin在Pertuzumab組的發生率較高(表二)
Pertuzumab的懷孕分級為D級。在動物實驗中給予猴子Pertuzumab會導致oligohydramnios(羊水過少)、delayed fetal kidney development(胎兒腎臟發展的延遲)及embryo-fetal death(胚胎-胎兒的死亡),因此有懷孕的婦女不建議使用。如在懷孕期間需施打本藥或是在治療期間懷孕者,均需要告知病患可能對胎兒的傷害,並建議須進行有效的避孕措施。
表二:Pertuzumab治療組與Placebo治療組副作用之比較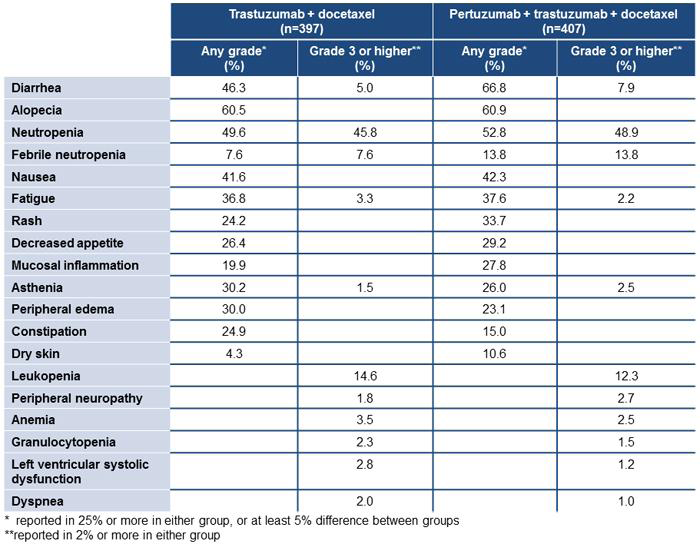
抑制HER2活性的藥物曾造成left ventricular ejection fraction(LVEF)的降低,因此在使用Pertuzumab也要注意這個副作用。雖然在臨床試驗中無法證明有症狀的左心室收縮功能不全(symptomatic left ventricular systolic dysfunction;LVSD)發生率上升或LVEF的降低與Pertuzumab 有關,但在試驗中還是有4.4%接受Pertuzumab治療的病人發生LVSD,因此有心衰竭的病患是不建議使用的。在試驗中,有10.8%接受Pertuzumab治療的病人發生過敏反應,因此對Pertuzumab過敏者是絕對禁忌。
五、臨床試驗實證:
Pertuzumab在的CLEOPATRA臨床試驗中收錄了808名HER2-positive轉移性乳癌病患,以1:1隨機投予病患Pertuzumab + Trazumab + Docetaxel或Placebo + Trazumab + Docetaxel的組合作為治療,試驗的primary endpoint是以independent review facility(IRF)所評估的progression-free survival(PFS)所訂定。
結果 Pertuzumab組的IRF-assessed PSF與Placebo組相比在統計上有顯著的改善[hazard ratio=0.62(95% CI: 0.51, 0.75, p<0.001)],兩組的平均PSF相差了6.1個月(Pertuzumab組的平均PFS為18.5個月vs. Placebo組的12.4個月) (圖二)。在實驗終止時的死亡人數總計有165位病患, Placebo組死亡的人數(23.6%)大於Pertuzumab組(17.2%)。
圖二:Progression-free Survival, as Assessed at an Independent Review Facility.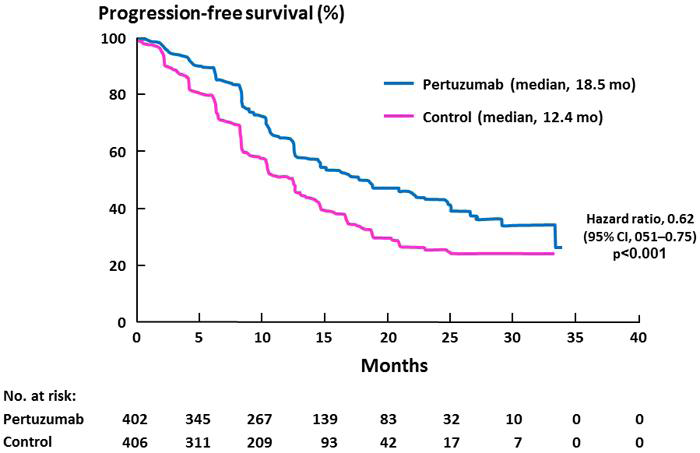
六、討論
CLEOPATRA臨床試驗證明Pertuzumab與Trazumab及Docetaxel合併使用可以顯著提升病人的存活期,因此被FDA核准上市。目前Pertuzumab在台灣還尚未上市,但相信將來也能為台灣轉移性乳癌的病患帶來治療的新希望。
七、Reference
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C and Parkin DM GLOBOCAN 2008, Cancer Incidence and
Mortality Worldwide: IARC Cancer Base No. 10 [Internet].Lyon, France: International Agency for Research on
Cancer; 2010. Available from: http://globocan.iarc.fr
2. Gabriel L. Fiszman and María A. Jasnis, “Molecular Mechanisms of Trastuzumab Resistance in HER2 Overexpressing
Breast Cancer, International Journal of Breast Cancer, Volume 2011 (2011), Article ID 352182, 11 pages
3. Youngjin Park, Tomoaki Kitahara, Ryuichi Takagi and Ryoji Kato., “Current status of therapy for breast cancer
worldwide and in Japan”, World J Clin Oncol 2(2):125-134. Published online 2011 February 10,
http://www.wjgnet.com/2218-4333/full/v2/i2/125.htm
4. Baselga J, Cortés J, Kim SB, et al, “Pertuzumab Plus Trastuzumab Plus Docetaxel for Metastatic Breast Cancer,”
N Engl J Med, 2012, 366(2):109-19. [PubMed 22149875]
5. Pertuzumab(Perjeta®) 仿單
6. Uptodate
7. Micromedex
|